Introducción

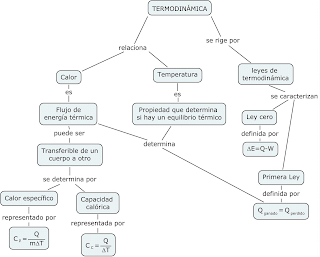
 De acuerdo a la primera ley de la termodinámica, que indica concretamente la conservación de la energía, ya que no hay pérdida de ésta hacia los alrededores; se puede determinar la capacidad calorífica de un sistema. La capacidad calorífica es la cantidad de Energía necesaria para producir un asenso de temperatura en un grado. De ésta se puede diferenciar de procesos que se realizan a volumen constante (Cv) y a presión constante (Cp), siendo distintas en magnitud. También es necesario considerar el calor específico, puesto que éste relaciona la energía necesaria para producir el asenso de la temperatura en un grado, por gramo de masa. Lo anterior resulta de gran importancia, puesto que se puede contrastar una propiedad intensiva (calor específico) con una propiedad extensiva (capacidad calorífica).
De acuerdo a la primera ley de la termodinámica, que indica concretamente la conservación de la energía, ya que no hay pérdida de ésta hacia los alrededores; se puede determinar la capacidad calorífica de un sistema. La capacidad calorífica es la cantidad de Energía necesaria para producir un asenso de temperatura en un grado. De ésta se puede diferenciar de procesos que se realizan a volumen constante (Cv) y a presión constante (Cp), siendo distintas en magnitud. También es necesario considerar el calor específico, puesto que éste relaciona la energía necesaria para producir el asenso de la temperatura en un grado, por gramo de masa. Lo anterior resulta de gran importancia, puesto que se puede contrastar una propiedad intensiva (calor específico) con una propiedad extensiva (capacidad calorífica).
Los cambios térmicos en las reacciones químicas se miden efectuando el proceso en forma adecuada en un calorímetro. El equivalente en agua (capacidad calorífica) del calorímetro se pude determinar multiplicando los diversos pesos de la vasija calorimétrica, por sus respectivos calores específicos; a éste producto se le suma el peso del agua de la vasija y la suma se multiplica por la elevación de la temperatura, lo resulta el calor desarrollado en la reacción.
Conceptos fundamentales
Materiales
 2 vasos de icopor con tapa
2 vasos de icopor con tapa
Termómetro
Beacker 200mL
1 trípode
1 malla de asbesto
1 mechero
Bloques metálicos
1 cuchara de combustión
1 probeta de 100mL
Reactivos

Agua destilada
Equipos

1 balanza digital
Procedimiento: Diagrama de flujo
 Datos necesarios para el análisis
Datos necesarios para el análisis
- Para la determinación del Cp del calorímetro.

- Para determinar el Cp del metal:











No hay comentarios:
Publicar un comentario